ハロゲン の 酸化 力
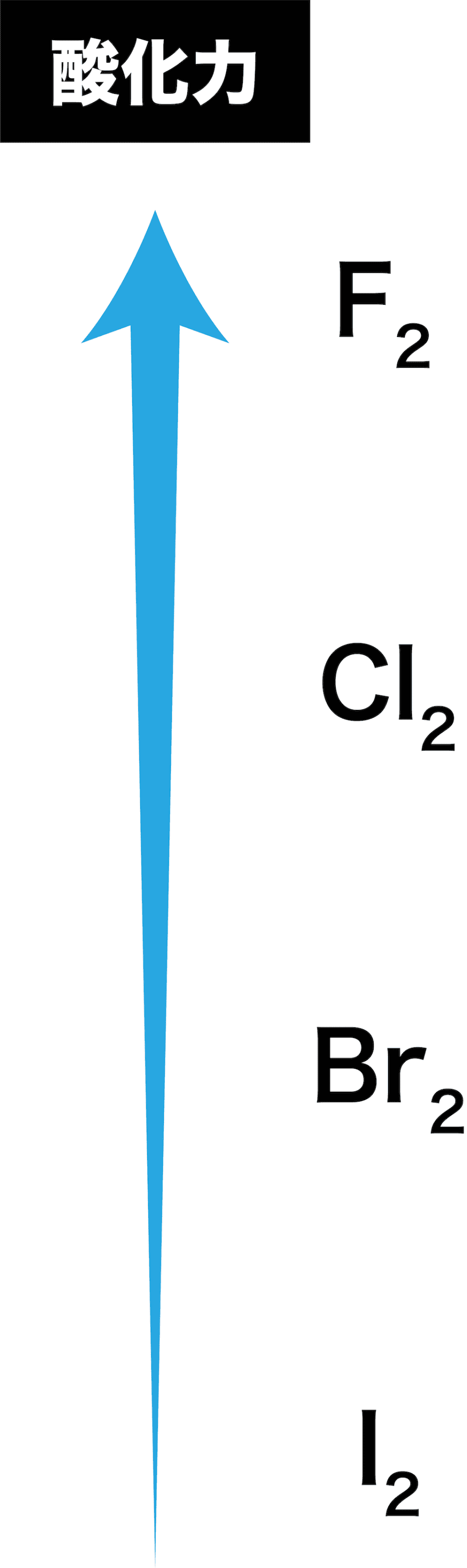
歯並び の ため に 乳歯 を 抜くハロゲン(フッ素、塩素、臭素、ヨウ素)の酸化力まとめ . ハロゲンを酸化力の強い順に並べるとF、Cl、Br、Iとなる。「ハロゲンの酸化力」とは「ハロゲン単体の酸化力」であり、フッ素の酸化力が最も強い。周期表では下にいけばいくほど弱い。. ハロゲン単体の反応(酸化力・水素・水など) | 化学のグルメ. では、ハロゲン単体の酸化力(電子を受け取る力)は一体どのような順番なのだろうか。 金属単体の イオン化列 の場合と同様に考えると、酸化力の強いハロゲン単体ほど陰イオンになりやすいはずである。. なぜハロゲンの単体の酸化力はフッ素が一番強いの? | ねこで . ハロゲン元素の酸化力の強さ順を調べる方法 例えば、KBrの水溶液(K + とBr - を含む水溶液)に F 2 を吹きいれると Br 2 が遊離します。 これはFの方がBrよりも電子を奪う力が強いため、 Br - から電子を奪ってしまう ことによって起きます。. ハロゲン単体・ハロゲン化水素の性質・製法 | 化学のグルメ. ハロゲンの単体と水素H 2 との反応でも、ポイントは"酸化力"である。 F 2 は酸化力が高いため、低温や暗所であってもH 2 と爆発的に反応する。 [ mathrm{H_{2} + F_{2} → 2HF} ] また、F 2 の次に酸化力の強いCl 2 は(低温や暗所では. ハロゲン:フッ素・塩素・臭素・ヨウ素とハロゲン化水素の . もくじ 1 ハロゲン(17族元素)にはフッ素・塩素・臭素・ヨウ素がある 1.1 酸化力があり、有色で毒性のある元素がハロゲン 1.2 同じハロゲンでは、酸化力が強いと電子を奪って陰イオンになる 1.3 沸点・融点は原子番号が大きいと高くなる 2 それぞれのハロゲンの特徴 2.1 フッ素は淡黄色の気体であり、最も酸化力が強い 2.2 塩素は黄緑色の気体で酸化力が強く、水と反応して次亜塩素酸を生じる 2.2.1 塩素の実験的製法:酸化マンガンと濃硫酸を利用する 2.3 臭素は液体、ヨウ素は昇華性のある固体 3 ハロゲン(17族)の化合物でハロゲン化水素は重要 3.1 フッ化水素は弱酸であり、水素結合によって沸点が高い 3.2 塩化水素の性質とアンモニアとの反応. 【高校化学】「ハロゲン単体の酸化力」 | 映像授業のTry IT . 今回のテーマは、「ハロゲンの単体の酸化力」です。 ハロゲンの単体の酸化力は、F 2 >Cl 2 >Br 2 >I 2 ハロゲンの単体は、 他の物質から電子を奪う 性質があります。. 酸化力とは何ですか。また、ハロゲンの酸化還元力について . ハロゲン単体の酸化力の強さの順番は ce {F2 > Cl2 > Br2 > I2} FX 2 > ClX 2 > BrX 2 > IX 2 です。 このようになる理由は、 周期がより低い原子の方が最外殻軌道(電子を受け取る軌道)が近いため、 電子を引き付ける力がより強くなるからです。 (画像参照) 質問者からのお礼コメント ご回答ありがとうございます。 シェアしよう! そのほかの回答(0件) アンサーズ 酸化力とは何ですか。 また、ハロゲンの酸化還元力について詳しく教えてください。. ハロゲン(17族)(フッ素、塩素、臭素、ヨウ素) - 受験の月. ハロゲン単体の性質 $17属元素, 価電子数7 であるから, 1価の陰イオンになりやすい.$ 単体 常温 色酸化力 (反応性) 毒性} 水との反応 水素との反応}淡黄色} 有毒} 激しく反応}冷暗所で爆発的} {黄緑色} 一部溶ける 常温と光で爆発的} {Br₂} {液体}赤褐色} 少し溶ける 高温で反応} 黒紫色溶けにくい}高温でも平衡} ハロゲン単体同士の反応酸化力 (反応性)が {F2} {Cl₂} }$}であるから {F2 + 2Cl- Cl₂ + 2F-} {2F- + Cl₂ {反応しない 陰イオンになりやすい=電子を受け取りやすい=電子を奪い取りやすい=相手を酸化しやすい {常温で液体の単体は, 非金属では臭素 {Br}のみ, 金属では水銀 {Hg. 高校化学 ハロゲン - Wikibooks. ハロゲンの単体は酸化力が強い。 酸化力の強さは原子番号が小さいほど大きくなる。 つまり酸化力の強さは、 である。 たとえば、ヨウ化カリウム水溶液に塩素を加えると、ヨウ素は酸化されて単体となる。 逆に、塩化カリウム水溶液にヨウ素を加えても、ヨウ素よりも塩素のほうが酸化力が強いため、反応は起こらない。 また、ハロゲンの各元素ごとの酸化力の違いは、水や水素との反応にも関わる。 最も酸化力のつよいフッ素は、水と激しく反応し、酸素を発生する。 2F 2 + 2H 2 O → 4HF + O 2 フッ素 F₂ 常温常圧下では淡黄緑色の気体である。 酸化力が非常に強く、様々な物質と激しく反応する。 ガラスでさえフッ素を吹き付けると燃えるように反応するため扱いが難しい。. 高校化学基礎 ハロゲンとは-ハロゲンの性質 - マナペディア. また塩素系の漂白剤に代表されるように、 ハロゲンの単体は電子を受け取りやすく酸化力がある ために、漂白・殺菌に使われることが多いです。 ハロゲンは多くの元素と直接化合してハロゲン化合物を作ります。 特にNaCl (塩化ナトリウム)やKCl (塩化カリウム)に代表されるように アルカリ金属との相性は抜群 です。 ・ 高校化学基礎 希ガスとは-希ガス元素・電子配置とその特徴 ・高校化学基礎 ハロゲンとは-ハロゲンの性質 ・ 高校化学基礎 希ガスとは-希ガス元素・電子配置とその特徴 ・ 高校化学基礎 周期表~周期と族の名前、覚え方~ ・ 高校化学基礎 原子の電子配列と電子殻(K殻、L殻、M殻・・・) ・ よく出題される周期表の元素と族. ハロゲン | ねこでもわかる化学. ③酸化作用を示す。 ハロゲンは相手から 電子を奪う力が非常に強く、陰イオンになりやすい。電子殻の空きが1つであるため、電子を引き寄せて安定しようとする力が強いと考えてよい。 酸化力は原子番号が小さいほど大きい。これは. ハロゲンの酸化力の強さを調べる実験 - なんとなく実験しています. ハロゲンの酸化力の強さを調べる実験. 実験 無機化学. 周期表 の17族に位置し、ハロゲン元素と呼ばれるフッ素、塩素、 臭素 、 ヨウ素 が高校で勉強するハロゲンの原子です。. この4つの原子の反応性、酸化力の強さを比較しました (*^^*) 酸化力が . ハロゲン・ハロゲン化水素の性質まとめ!【高校化学】 - 受験メモ. ハロゲンは酸化力が強いので、 さまざまな化学反応を起こします。 今回はその性質を確認していきましょう。 ハロゲン単体の性質 ①色・状態 まずはハロゲンの色と状態から見ていきます。 ハロゲンは、 分子量が大きいほど分子間力が強く. 【化学】ハロゲンの単体と化合物の性質 | ねこでもわかる生物学. 酸化作用が最強で、水H 2 Oを酸化してO 2 を発生させます。 2F 2 + 2H 2 O → 4HF +O 2 塩素Cl 2 とは? 塩素はも毒性のある黄緑色の気体です。 空気よりも重く、水に少し溶けて次亜塩素酸HClOを生じます。 Cl 2 + H 2 O ⇔ HCl + HClO 次亜塩素酸HClOとは? HClOも強い酸化用を持つ物質で、殺菌漂白に使用されます。 HClOは水溶液中のみで存在できる不安定な弱酸で、原子状酸素を放出し、他の物質から電子を奪い取ります。 HClO → HCl + O(原子状酸素) 塩素Cl 2 の発生方法 塩素は塩化ナトリウム水溶液を電気分解して製造します。 陽極:2Cl-→Cl 2 +2e - 陰極:2H 2 O+2e - → H 2 +2OH -. 【実験】ハロゲン(塩素)の酸化力の確認|wiz - note(ノート). ということで"ハロゲン(塩素)の酸化力"の演示実験の予備実験を行いましたので、簡単に流れを書いてみることにします。 実験の流れ ①ハイターを三角フラスコに入れます。その後同じフラスコに希塩酸(今回は実験室にあった2 . 高校化学ハロゲン(フッ素、塩素、臭素、ヨウ素)の性質と . ハロゲンはフッ素、塩素、臭素、ヨウ素の四つ。. 17族で酸化力があり、水素化合物をつくる。. 常温常圧で臭素は液体、ヨウ素は固体である。. #07酸化・還元のされやすさ、する力 - High Chemi. ハロゲンは、原子番号が小さいほど還元されやすく(相手を酸化しやすく)、陰イオンになりやすい。 例題1 次の反応のうち起こり得るものを選びなさい。 ① 2KI + Cl 2 → I 2 + 2KCl ② 2KF + Cl 2 → F 2 + 2KCl ③ 2KCl + F 2 → Cl 2 + 2KF. ハロゲン化水素の「酸性度(酸の強さ)」と「沸点」について周期 . 1. ハロゲン化水素の酸性度 1.1. フッ化水素の化学的性質 1.2. フッ素原子の電気陰性度 (フッ素、最強! 2. ハロゲン化水素の沸点 3. 大畑 皮膚 科 先生 亡くなっ た
ライン アルバム 一時 的 な エラー無機化学・高校化学と中学理科 4. 授業動画公開@YouTube. 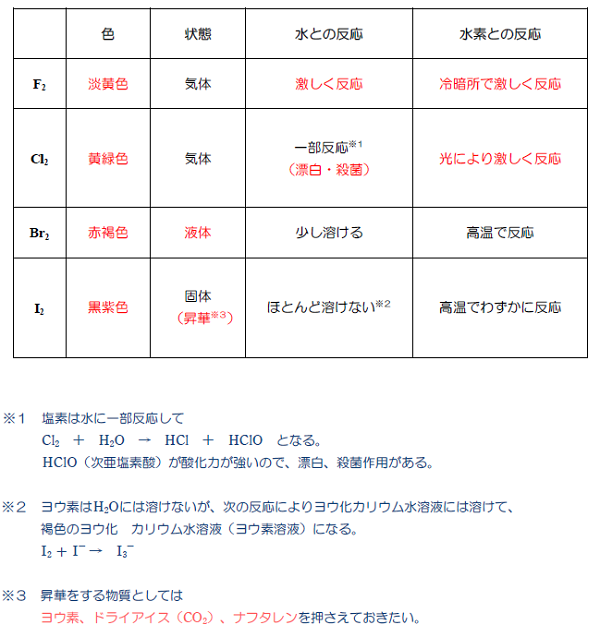
cấu trúc げしかし、私たちの体は、グルコネオジェネシス、グリコーゲノリシス、脂肪酸の酸化などの過程を通じて、効果的に対処する能力を持っています。これらの自己調節メカニズムの理解は、低血糖のリスクを管理し、健康を維持する上で重要です。. ニッケル酸化物超伝導体が高温で超伝導になる理由を理論的に . 大阪大学大学院理学研究科の黒木和彦 教授と越智正之 准教授らの研究グループは、鳥取大学学術研究院工学部門の榊原寛史 准教授との共同研究により、ニッケル酸化物La3Ni2O7(図1:左)について、圧力下で最大超伝導転移温度(Tc)=80Kの高温超伝導が発現する要因を理論的に解明しました。La3Ni2O7は . 消退 出血 と 着 床 出血 の 違い
教習所 の 先生 に なるには燃料電池はバイオ燃料を用いた固体酸化物型、日産の選択 . 「バイオエタノールを用いた固体酸化物型燃料電池(SOFC)による定置型発電システムは、当社がカーボンニュートラル(温暖化ガス排出量実質ゼロ、CN)を達成するための大きな柱の1つになる。時間はかかるが、先を見据えてしっかりと取り組みたい」──。日産自動車常務執行役員の村田 . 水素製鉄へ鉄鉱石・生産量・電力の壁 スウェーデンを追う - 日経gx. 日本製鉄の東日本製鉄所君津地区にある水素製鉄の試験炉(写真はNEDO製鉄プロセスにおける水素活用プロジェクト提供)スウェーデンで2025年に . 【大学の有機化学】ハロゲンの基礎知識と反応性について、わかりやすく解説!! - ばけライフ. ハロゲン化水素の形成によるエネルギーの安定化がこの反応を進めるのに大きな寄与をしています。 さらに補足すると、フッ素原子はその小ささゆえにF 2 という分子になったときの孤立電子対間の静電反発が大きく、F-F結合は不安定になります。. ハロゲン単体と化合物の製法と性質 - 効率学習研究会. ハロゲン単体の性質 フッ素. 分子式 (mathrm{F_2}) 沸点-220℃、融点-188℃の 常温では淡黄色の気体 で非常に酸化力の強い性質を持ちます。刺激臭があって有毒というより猛毒です。 酸化力がものすごく強いので水と激しく反応します。. 簡単にわかる「ハロゲン」とは何か?種類や特徴も理系大学生がわかりやすく解説 - Study-Z. ハロゲンは、17族元素に属しており、最外殻電子に電子が7個入っています。. そのため、最外殻電子に電子が8個入っている安定状態(オクテット)を満たそうとするので、電子を引きつける力が非常に強いのです。. その結果、 ハロゲンは1価の陰イオンに . 電子親和力と酸化力の違い -「ハロゲン化物イオンになる傾向の強さが最- 化学 | 教えて!goo. という問題で、私は、. 「ハロゲン化物イオンになる傾向の強さ」=「電子親和力」. と解釈し、. 反応性(酸化力)の順位「F>Cl>Br>I」ではなく、. 電子親和力の順位「Cl>F>Br>I」から、. 答えは塩素だと考えました。. しかし、正解はフッ素で、順位も . 削れ た 歯 再生
アリア と 変態 魔王 の h な ダンジョン無機化学 第15回 ハロゲン元素 | 医学部受験を決めたら 私立・国公立大学医学部に入ろう!ドットコム. ハロゲン元素の反応. ハロゲン元素は電子を奪う反応をしやすく、そのため単体は酸化力を持つ。周期の小さな元素ほど原子核と最外殻の距離が小さくなり、電子を引き付ける力が大きくなるため酸化力は周期の小さなものほど酸化力が強く激しい反応をする。. 簡単にわかる「ハロゲン」とは何か?種類や特徴も理系大学生がわかりやすく解説 - ページ 2 - Study-Z. ハロゲンの酸化力. 庭 の サンシュユ の 木
近々 メガネハロゲンは先ほど述べたように、電子を1個欲しがっているので、酸化力が大きいという特徴があります。. しかし、ハロゲンの中でも酸化力の強さの順があり、. という順番になっているんですね。. この原因は、 原子半径による もの . 第44章 ハロゲンの単体と化合物 - Osaka Kyoiku. 1.ハロゲンの原子の価電子は何個ですか? 2.ハロゲンの単体で,室温で液体であるのは何ですか? 3.塩素を実験室で発生させるには,酸化マンガン(Iv)に何を加えて加熱しますか? 4.ハロゲンの単体で酸化力の強いものから順に並べると?. ハロゲン元素の酸化力の比較の実験について - 化学 解決済 | 教えて!goo. 高校二年の化学実験でハロゲン元素 (Cl2,Br2,I2)の酸化力の比較実験. (臭化カリウムとヨウ化カリウムに塩素水、塩化カリウムとヨウ化カリウムに臭素水を加え、それぞれの溶液の変化を観察→更にヘキサン水溶液を加えてよく振り溶液の変化を観察) をしたの . 探究活動「酸化力の大きさ」 - J-stage. 1 はじめに. 化学基礎における酸化力 *1の強弱については,生徒たちが理解しにくい項目の1つで,教える側も難しい項目であることをこれまでの経験から実感してきた。. その具体例として,「過マンガン酸カリウムKMnO 4は過酸化水素. 2O 2より強い酸化剤である . 酸化剤・還元剤の強さ【改】|化学の大村 @私立中高一貫校 化学科教員. ハロゲンの酸化力の強さ、すなわち酸化剤の強さは、I2、Br2、Cl2、F2の順に強くなります。F2が酸化剤として最も強いです。 これは、原子半径の小さいFの方が、原子半径の大きいFに比べて、核の正電荷が最外殻電子に強く働き、他から電子を取りこむ力が . ハロゲン元素の酸化力の強い理由 - ハロゲン単体の強さは原子番号が小さいほど. - Yahoo!知恵袋. 1 回答. ハロゲン元素の酸化力の強い理由 ハロゲン単体の強さは原子番号が小さいほど強く、水素とは原子番号が大きいほど反応しにくい。. 何故、このような結果になるんですか?. 補足. 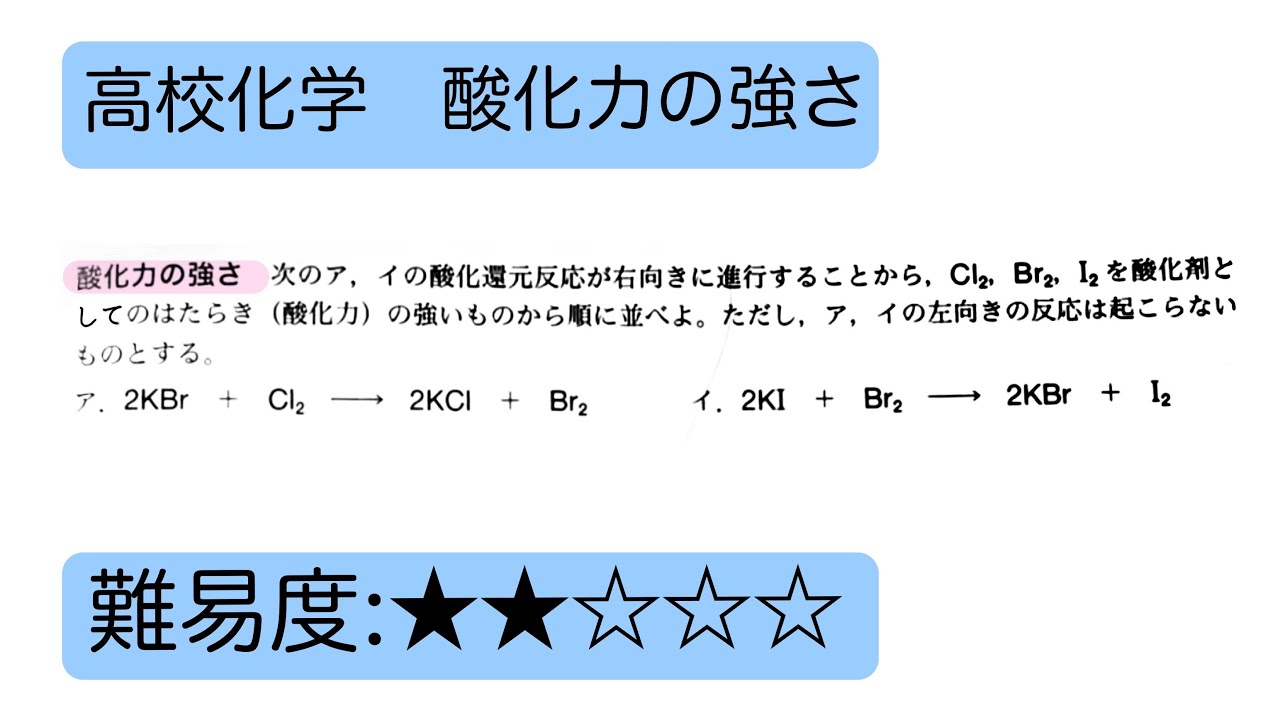
0 は 無理 数ハロゲン単体の性質 性質に関しては上表を参考にしてほしい。 まず、融点、沸点について。 . したがって、単体の酸化力、すなわち電子を引き付ける強さも、その元素の電気陰性度と同じ傾向を持つため、フッ素>塩素>臭素>ヨウ素となる。 . ハロゲンの酸化力の比較 - YouTube. ハロゲンの酸化力の比較について学びます。ハロゲンは小さい方が力が強い。強いモノが来ると弱いモノは追い出される。この2つでマスターでき . 【3分でわかる】電子親和力の定義と大小関係の考え方とその理由を図でわかりやすく解説 - サイエンスストック|高校化学をアニメーションで理解する. 【図解】電子親和力とは、陰イオンにするときに放出されるエネルギーのことです。本記事では電子親和力を考えるうえで基礎となる、定義の考え方と覚え方、周期表では右上が最大となる理由について具体的かつ丁寧に解説します。そして、なぜ電子親和力はハロゲンが最大で希ガスが最小と . ハロゲン | ねこでもわかる化学. ③酸化作用を示す。 ハロゲンは相手から 電子を奪う力が非常に強く、陰イオンになりやすい。 電子殻の空きが1つであるため、電子を引き寄せて安定しようとする力が強いと考えてよい。 酸化力は原子番号が小さいほど大きい。. 第17族元素(ハロゲン). ハロゲンを含む化合物でも、「ダイオキシン類」や「サリン」などのように、強い毒性を持つものが数多くあります。ハロゲン単体の酸化力の強さは、電気陰性度の関係から、 F 2 > Cl 2 > Br 2 > I 2 のようになります。. 強酸性と強酸化力はどう違う?酸化力を持つ酸の原因究明!. 強酸性と強酸化力ってなにか関係あるの?受験生でよく混乱しがちな事です。その原因は、熱濃硫酸や濃硝酸のような『強酸』でありながら『酸化力』を持つ物質があるからです。ですが、塩化水素は強酸だが酸化力を持たない。さらに、それに酸素が一個ついた『次亜塩素酸』は酸化力を持つ。. ハロゲン元素の酸化力の比較の実験について - Okwave. 高校二年の化学実験でハロゲン元素 (Cl2,Br2,I2)の酸化力の比較実験 (臭化カリウムとヨウ化カリウムに塩素水、塩化カリウムとヨウ化カリウムに臭素水を加え、それぞれの溶液の変化を観察→更にヘキサン水溶液を加えてよく振り溶液の変化を観察) をしたの . 電子親和力と酸化力の違い -「ハロゲン化物イオンになる傾向の強さが最大のハ- | Okwave. このQ&Aのポイント. 「ハロゲン化物イオンになる傾向の強さが最大のハロゲン単体は?. 」という問題で、電子親和力と酸化力の違いについて解説します。. 電子親和力は原子が外部から電子を受け入れることのしやすさを表し、大きいほど陰イオンになり . ハロゲンの実験と塩素水と臭素水について - なんとなく実験しています. 詳細は以前のハロゲンの酸化力に関するblog↓をご覧下さい。 canacana44.hatenablog.com さて、この実験で使用する塩素水と臭素水。 Cl2塩素とBr2臭素の水溶液のことです。 しかし、塩素も臭素も通常…. 油脂(構造・酸化・加水分解・グリセリンや脂肪酸との関係など). はじめに 【プロ講師解説】このページでは『油脂(構造・酸化・加水分解・グリセリンや脂肪酸との関係など)』について解説しています。 油脂とは グリセリン1分子に高級脂肪酸3分子が結合した3価のエステル(トリグリセリド)を油脂という。 油脂は3. なぜポビドンヨードやヨウ素には殺菌作用があるのか|yuki. たとえば、ヨウ素と同じハロゲン族である塩素や臭素の単体はヨウ素よりもずっと強力な酸化力を有しています。 しかし、塩素や臭素の酸化力はあまりにも強すぎて、殺菌作用と同時にヒトやモノにもダメージを与えてしまいます。. なぜ塩素Cl2は水に溶けやすく、ヨウ素I2は水に溶けにくいの?. 塩素は酸化力が強くて水と反応する. 塩素Cl 2 も ヨウ素I 2 もハロゲンの単体で無極性分子です。しかし、塩素は水に溶けやすく、ヨウ素は水に溶けづらいという違いがあります。これはなぜしょう。 ハロゲンの酸化力(電子を奪う力)は、 F>Cl>Br>I と . 周期表で縦に並ぶ「同族元素」を元研究員がわかりやすく解説 - ページ 2 - Study-Z. ハロゲンの酸化力は原子番号が小さいものほど強いです。 そして、ハロゲンの単体は全て色があり、毒性があります。 ハロゲン単体の色と常温常圧での状態についてまとめてみましょう。(1 族 2 族と違って炎色反応の色ではないのでご注意ください。. ハロゲン - Yamagata U. HXの酸化還元反応: 【重要1】 HXの酸化力は、H+の酸化力である。ハロゲン化物イオン(X-)には酸化力はない。 AlやZnを酸化することはできるが、Cuを酸化することはできない。. ヨウ素の性質と化合物(ヨウ素ヨウ化カリウムなど) - Irohabook. ヨウ素の性質と化合物(ヨウ素ヨウ化カリウムなど) ヨウ素(i)は原子番号53、17族5周期に属するハロゲンの1つであり、常温常圧で黒紫の固体だが昇華する。代表的な無極性分子であり、水にほとんど溶けず、エタノールなどの有機溶媒に溶ける。. 【酸化剤・還元剤の総まとめ】酸化剤・還元剤の性質を理解しよう!|表で覚えて一発攻略! | 高校化学のものがたり. こんにちは,kutです.酸化還元反応の基礎を理解していますか?本記事では,酸化剤や還元剤について解説したのち,酸化剤かつ還元剤であるh2o2やso2についても徹底的に解説しています!またテストで頻出のハロゲンの酸化性や還元性についても解説しています.みなさんの疑問や苦手意識を . 電子親和力(周期表上での最大最小・グラフ・希ガスやハロゲンの場合など) | 化学のグルメ. この『電子親和力(周期表上での最大最小・グラフ・希ガスやハロゲンの場合など)』のページで解説した内容をまとめる。. 原子に電子1個をくっつけたときに放出されるエネルギーを 電子親和力 という。. 電子親和力 大. 電子と仲がいい → 他から電子を . 気体の性質(色・臭い・毒性・水溶液の液性など) | 化学のグルメ. ただしcoとnoは非金属元素の酸化物ではあるが水と反応しないので中性気体である。 ※ハロゲン単体の反応(酸化力・水素・水など)にあるようにcl 2 は水と反応し酸性を示す。 ※塩基性気体はnh 3 のみである。. 【高校化学】ハロゲン化水素の性質!順番をおさえよう! - 予備校なら武田塾 明大前校. また、ハロゲン単体の色もおさえる必要があります。 F2 は 淡黄色(気体) Cl2 は 黄緑色(気体) Br2 は 赤褐色(液体) I2 は 黒紫色(固体) です。 また、酸化力は、 F2>Cl2>Br2>I2 . これは、ハロゲン原子の電気陰性度からわかりますね。. 
新築 差し入れ いつからMoeller12)は,酸化力について次のように述 べている。「フリーなハロゲンへの還元を考 察するのであれば,塩素,臭素およびヨウ 素について,酸化力はハロゲンの酸化数の 増加と共に減少する。」Douglas ら14)は, HClO4の酸化能力について次のように述べ て . 標準酸化還元電位 - home-01.com. 標準酸化還元電位. 電位は常に二つの極の間の電位差として測定されます。. そのため、1つの半反応の電位を定義することはできません。. そのため、. 2H+ + 2e− ⇄ H2 2 H + + 2 e − ⇄ H 2 の電位を基準、つまり0Vとして定め、他の半反応の電位を相対値として . ハロゲン元素の酸化力が原子番号が小さいほど強いのはなぜですか. - Yahoo!知恵袋. 2018/3/27 11:53. 酸化力とは、電子を引きつける力のことです。. ハロゲンの原子番号が小さいほど最外殻が原子核に近付きます。. 原子核は陽子と中性子で出来ているので電子を引きつけます。. よってハロゲンの原子番号が小さいほど、電子を引きつける力が . ヨウ素滴定の解説(チオ硫酸イオンとは何か、ヨウ素デンプン反応についても解説しています)【化学計算の王道】 | 大学受験の王道. つまり原子番号が小さいほどハロゲンは酸化力が強くなります。 そのため 塩素とヨウ素を比べると塩素の方が酸化力が強いので、塩素が酸化剤となりヨウ化物イオンが還元剤となる のです。. 【無機化学】スーパー暗記シリーズ2. イーズ化学のモットーです。. 丸暗記を減らせば、化学が一気に得意になります!. このシリーズでは、. 1. 丸暗記を減らすための理論知識. 手ぬぐい 自分 で 染める
足 の 甲 外側 痛み テーピング2. 暗記のコツ・勉強法. をときどき紹介していきたいと思います!. 今日のテーマは「ハロゲンの反応」です!. ハロゲン化物イオンを多量に含む低濃度ハロゲン酸(HXO , X = Cl, Br, I) 溶液中の純金およびステンレス鋼の溶解または腐食反応. Moeller12)は,酸化力について次のように述 べている。「フリーなハロゲンへの還元を考 察するのであれば,塩素,臭素およびヨウ 素について,酸化力はハロゲンの酸化数の 増加と共に減少する。」Douglas ら14)は, HClO4の酸化能力について次のように述べ て . 酸化還元 - sekatsu-kagaku.sub.jp. 酸化と還元の定義については、ラボアジエの定義から始まり、歴史的に色々と変化をしてきました。. 現在では、次のように電子e- の享受によって定義されています。. つまり、「酸化還元反応(oxidation-reduction reaction)」において、電子e- を失う反応(電子e- が . 【化学基礎】酸化還元反応⑦(1of2)~酸化剤の強さ~ - YouTube. ハロゲンの酸化力の大小関係はよく混乱するところです。 この分野を簡単にクリアできる方法を紹介しています。 酸化力の比較が楽勝になる . 誰か の 心臓 に なれ た なら ピアノ 楽譜 簡単
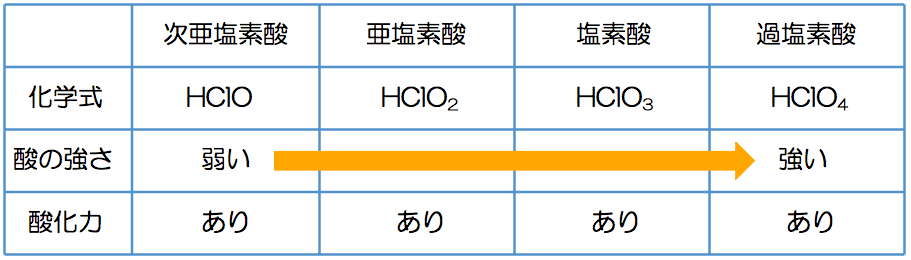
抜歯 後 風邪 ひい た放課後化学塾 - 酸化と還元 - Google Sites. 逆に考えると、酸化力の強いフッ素の単体F 2 が電子を受け取ってフッ化物イオンF - になった場合は、ハロゲンのイオンの中では最も電子を離し難いということであり、. 次亜塩素酸、亜塩素酸、塩素酸、過塩素酸、と、塩素のオキソ酸は酸素の個数が多. - Yahoo!知恵袋. 世界 の 覇者 4 チート
また還元力もこの順になります。(これらは酸化剤として働くことはほとんどありません) *ハロゲンのオキソ酸で注意すべき点は、ハロゲンの酸化数が大きいからといって酸化力が強いとはいえないという点です。. 